|
Instituto de Conservación y Mejora de la Agrodiversidad Valenciana (COMAV) Grupo de Biología Celular |

|


|
Dobles haploides en solanáceas recalcitrantes de interés agronómico.Dobles haploides Existen ya disponibles sistemas de producción de dobles haploides mediante inducción de androgénesis en varios cientos de especies de interés agronómico, desde herbáceas como trigo, cebada, arroz, colza, tabaco o maíz (revisado en Maluszynski et al., 2003) hasta leñosas como mandarino, naranjo amargo o alcornoque, entre otras (revisado en Srivastava y Chaturvedi, 2008). Sin embargo, salvo en especies modelo como colza, tabaco o cebada, la eficiencia en la obtención de dobles haploides androgénicos es todavía muy escasa (Touraev et al., 2001; Palmer y Keller, 2005; Seguí-Simarro y Nuez, 2008a). Este hecho es aún más crítico en especies hortícolas de elevado interés agronómico como las solanáceas. De los cinco principales cultivos de solanáceas (pimiento, tabaco, patata, berenjena y tomate), únicamente en tabaco se han hecho los progresos suficientes como para considerar esta especie como modelo, existiendo desde hace ya años sistemas puestos a punto para obtener dobles haploides a partir de cultivos de anteras y de microsporas aisladas con una eficiencia aceptable (Chupeau et al., 1998; Touraev et al., 2001; Maluszynski et al., 2003). En patata ya existen protocolos para inducir cultivos de microsporas (Rihova y Tupy, 1999). Sin embargo, el resto de solanáceas son consideradas recalcitrantes, pues aunque en algunos casos se han obtenido dobles haploides, todavía se está muy lejos de la eficiencia obtenida en tabaco o colza. En berenjena y pimiento únicamente parece puesto a punto el cultivo de anteras, al menos en algunos cultivares, y en tomate todavía no existe ninguno de los dos métodos puesto a punto. Pese a la proximidad genética de las cinco especies, parecen responder de forma muy distinta a la inducción androgénica, y en concreto tres de ellas, tomate (Solanum Lycopersicum), berenjena (Solanum melongena) y pimiento (Capsicum annuum), son especialmente recalcitrantes, por lo que se hace necesario profundizar en el estudio de estos sistemas, conocer mejor el proceso, encontrar nuevas vías de inducción de la androgénesis, mejorar la eficiencia de los métodos en su aplicación práctica, y si ninguno de estos enfoques funciona, usar otros enfoques alternativos, no basados en la inducción de androgénesis. Este es el caso del tomate, donde las aproximaciones basadas en el cultivo in vitro no parecen funcionar de manera eficiente, y las alternativas basadas en CENH3 para la eliminación cromosómica uniparental parecen más prometedoras.
A la vista de nuestros resultados de los últimos años, podemos concluir que la obtención de
dobles haploides en solanáceas recalcitrantes como tomate, berenjena y pimiento,
es posible aunque no fácil. Este será nuestro principal reto en esta línea de investigación. Dobles haploides en tomate El tomate es la primera hortaliza en producción y superficie cultivada tanto a nivel mundial como en la Unión Europea. En España, el tomate constituye la principal hortaliza. Sin embargo, y a pesar de su importancia, los avances en el campo de la obtención de dobles haploides mediante androgénesis han sido muy escasos y todavía no existe un método estandarizado y fiable en tomate. En los últimos 30 años se ha conseguido en la mayoría de los casos inducir callos o estructuras multicelulares, y regenerar raíces o brotes apicales. Tan solo dos laboratorios, incluyendo el nuestro, han publicado la regeneración de plantas completas de origen haploide o doble haploide (Shtereva et al., 1998; Zagorska et al., 1998; Seguí-Simarro y Nuez, 2005, 2006, 2007; Corral-Martínez et al., 2011). Frente a la alta variabilidad morfológica de los regenerantes publicada previamente, nuestros regenerantes presentan una alta homogeneidad morfológica, pero continúa observándose mixoploidía en un porcentaje de ellos y la eficiencia es aún baja (Seguí-Simarro y Nuez, 2007). Es obvio que el tomate es extremadamente recalcitrante, y todavía se debe profundizar mucho más en su estudio para obtener resultados satisfactorios. Entre 2005 y 2011, en nuestro grupo profundizamos de forma significativa en la problemática de la inducción de la androgénesis en este cultivo (Seguí-Simarro y Nuez, 2005, 2006, 2007; Corral-Martínez et al., 2011). Hasta ese momento no estaba clara la etapa del desarrollo del polen en la que se podía inducir este proceso en tomate. Nuestro grupo demostró que se puede inducir en dos etapas distintas, aunque con resultados y consecuencias enormemente distintas. Por una parte, es posible inducir los meiocitos (Figura 1), antes de que se acaben de tabicar para formar las tétradas, y siempre que éstos sean cultivados in vitro junto con las anteras que los contienen (Seguí-Simarro y Nuez, 2005; Corral-Martínez et al., 2011). De este modo se puede inducir a partir de estos meiocitos inmaduros la aparición de callos haploides y dobles haploides, pero sobre todo mixoploides (Seguí-Simarro y Nuez, 2007). Además, el hecho de que la antera esté también presente en el cultivo hace posible la aparición esporádica de regenerantes provenientes de dicho tejido, no 100% homocigotos y por tanto no deseables para nuestros fines. Estos fenómenos, inherentes a esta técnica, suponen un problema importante a la hora de traducir esta metodología experimental a una tecnología de producción, pues se hace necesaria la evaluación genética de cada regenerante de forma individual para determinar su origen y ploidía.
Por otra parte, y fruto también de nuestras investigaciones, hemos demostrado también que si aislamos y cultivamos en medio líquido microsporas en su estadio vacuolado, en lugar de meiocitos junto con la antera en medio sólido, es posible inducir divisiones embriogénicas en dichas microsporas (Seguí-Simarro y Nuez, 2007). Es decir, se podrían evitar los problemas antes mencionados, pues se elimina la influencia del tejido somático de la antera, y se obtienen directamente embriones, mucho más estables genéticamente y menos propensos a sufrir inestabilidades cromosómicas que los callos (Seguí-Simarro y Nuez, 2008b). Sin embargo, hasta ahora son muy pocos los genotipos que se han evaluado, y en los pocos resultados positivos que ha habido, no ha sido posible ir más allá de las primeras divisiones en el desarrollo de estos embriones derivados de microsporas. Por razones que de momento ignoramos, estos embriones se detienen y nunca progresan más allá de la etapa globular (Seguí-Simarro y Nuez, 2007). En definitiva, nuestro trabajo en tomate fue pionero en su campo y despejó algunas de las dudas más importantes que existían al respecto de la androgénesis en tomate. Por un lado se confirmó el meiocito como etapa inducible, pero se demostró su limitada aplicación práctica. Y por otro lado, se abrió una vía hacia la producción de dobles haploides androgénicos a través de la inducción de cultivos de microsporas, que demostramos que es posible, y del posterior desarrollo de los embriones obtenidos, aspecto éste en el que todavía queda trabajo por hacer. En paralelo a todo ello, los trabajos pioneros de Ravi y Chan en Arabidopsis (Ravi y Chan, 2010) demostraron que es posible obtener haploides y por consiguiente dobles haploides utilizando una aproximación completamente distinta a las utilizadas hasta entonces, y basadas en el cultivo in vitro y la inducción de androgénesis o ginogénesis. En 2010, estos investigadores demostraron que manipulando el gen de la histona centromérica H3 (CENH3) era posible conseguir versiones alteradas de esta proteína, y que cuando se cruzaba un individuo no transformado con un mutante con CENH3 alterada, se generaba en el cigoto diploide una inestabilidad en los cromosomas provenientes del individuo mutante, lo que provocaba su desaparición y acababa dando lugar a un individuo haploide con el genoma del parental no mutante. Este nuevo abordaje de la obtención de haploides (y posteriormente dobles haploides por duplicación cromosómica) ha abierto la puerta a su estudio y aplicación práctica en otras especies como cebada (Sanei et al., 2011) o maíz (Kelliher et al., 2016). Esto, unido al desarrollo de las herramientas de edición genética mediante CRISPR/Cas, está permitiendo el desarrollo de este tipo de abordajes con un mayor grado de precisión. Esta es una las líneas de investigación en las que estamos actualmente trabajando en tomate. Dobles haploides en berenjena La berenjena es otra de las hortalizas más importantes a nivel mundial. En Europa, España es el principal exportador, y el segundo productor. Esta especie parece responder mejor a la inducción a embriogénesis, y ya hay líneas dobles haploides de algunas variedades e híbridos (Rotino, 1996; Rivas-Sendra et al., 2017). Sin embargo, en la actualidad sólo parecen funcionar con cierta seguridad los cultivos de anteras. Los resultados tanto nuestros como de muchos otros grupos demuestran que se pueden inducir embriones a partir de microsporas de berenjena cultivadas dentro de la antera. De hecho, en nuestro llevamos ya años produciendo dobles haploides de berenjena mediante cultivos de anteras tanto de híbridos comerciales como de distintos materiales en distintas etapas del programa de mejora (Figura 2).
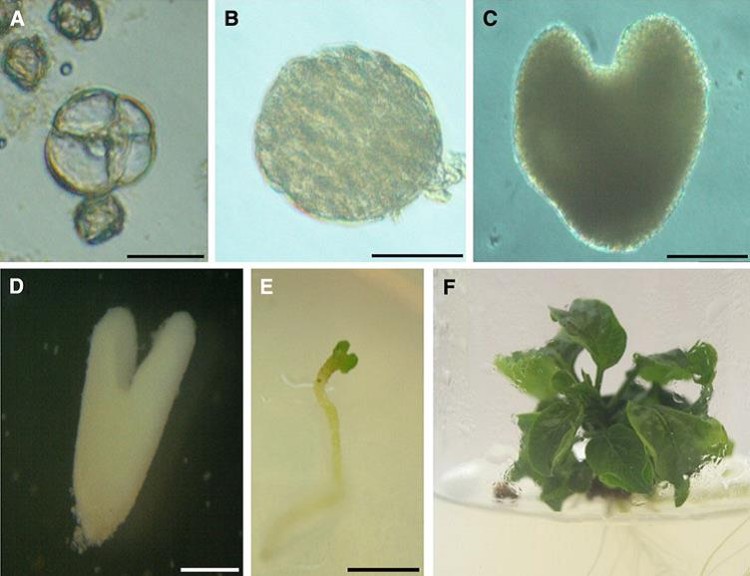
Sin embargo, el método de cultivo de anteras no permite descartar la aparición ocasional de embriones somáticos procedentes del tejido de la antera, al igual que hemos comentado en el caso del tomate. Además, hay que tener en cuenta el efecto secretor incontrolable del tapetum que rodea el saco polínico de la antera, y que nos impide tener un control estricto sobre las condiciones que operan en el cultivo. A esto hay que añadirle el hecho demostrado de que los cultivos de anteras tienen una eficiencia muy reducida, pudiéndose obtener únicamente unos pocos embriones por cada antera cultivada. En aquellas especies en las que los cultivos de microsporas aisladas están puestos a punto, se pueden obtener cientos e incluso miles de embriones a partir de las microsporas contenidas en una antera. Al igual que en tomate, sería muy deseable en berenjena la puesta a punto de un método de inducción de androgénesis que funcionase con microsporas aisladas, y que evitara los problemas antes citados de aparición de somáticos, efecto del tapetum y baja eficiencia. En nuestro grupo hemos avanzado en este campo (Corral-Martínez y Seguí-Simarro, 2012, 2014; Rivas-Sendra et al., 2015), desarrollando un protocolo mediante el cual estamos obteniendo inducción de microsporas aisladas y obtención de dobles haploides (Figura 3) con una elevada eficiencia, muy por encima de la previamente publicada.
En 2017 obtuvimos la primera línea de alta respuesta al cultivo de microsporas de berenjena (Rivas-Sendra et al., 2017), y en la actualidad, tratamos de optimizar más si cabe el protocolo, y sobre todo tratamos de solucionar uno de los problemas que todavía limitan la aplicación rutinaria de esta metodología. En los estadios más tempranos de la proliferación de las microsporas, estas se desarrollan para formar unas estructuras similares a embriones globulares, pero en vez de experimentar la transición de simetría radial a simetría bilateral y la consiguiente diferenciación de los distintos órganos típica de los embriones cigóticos, las células de los embriones androgénicos continúan proliferando de forma indiferenciada, formando estructuras de tipo callo. Aunque de ellos es posible obtener plantas haploides y dobles haploides induciendo la regeneración organogénica en dichos callos para obtener plantas completas, no cabe duda de que este proceso sería más rápido y sencillo si consiguiéramos que los embriones completaran todo su desarrollo, más allá de la etapa globular de manera que estuvieran listos para germinar de manera autónoma. Este es otro de los aspectos en los que trabajamos en la actualidad. Dobles haploides en pimiento El pimiento es la tercera solanácea que podríamos calificar como recalcitrante a la inducción androgénica. España suele ocupar el primer lugar o de los primeros lugares de la Unión Europea tanto en producción como en superficie cultivada de pimiento, lo cual da idea de la importancia que un método eficiente de obtención de líneas dobles haploides tiene en términos económicos. En pimiento, la situación es similar a la de berenjena. Desde hace años se utiliza el cultivo de anteras como herramienta tanto para estudios básicos (Seguí-Simarro et al., 2006; Parra-Vega et al., 2013a; Parra-Vega et al., 2013b) como para programas aplicados de mejora genética del pimiento. De hecho, al igual que en berenjena, nuestro grupo ha colaborado y colabora con distintas empresas e instituciones para la producción de dobles haploides mediante cultivos de anteras tanto de híbridos comerciales como de distintos materiales en distintas etapas del programa de mejora (Figura 4).
En todo el mundo, diversas empresas productoras de semilla híbrida utilizan esta técnica para obtener líneas puras. Lógicamente, esta técnica también conlleva los problemas descritos para el caso de berenjena (efecto del tapetum, posibilidad de somáticos y baja eficiencia), por lo que es igualmente deseable conseguir un protocolo de obtención de dobles haploides mediante cultivo de microsporas aisladas. A este respecto, existen en la literatura varias aproximaciones al cultivo de microsporas, como aislarlas directamente (Supena et al., 2006b; Kim et al., 2008) o cultivar las anteras en medios bifásicos (sólido-líquido) de modo que se promueva su dehiscencia y viertan las microsporas, que quedarían aisladas, atrapadas en la interfase (Supena et al., 2006a; Supena et al., 2006b). Algunas de ellas han mostrado una eficiencia limitada (Supena et al., 2006b). Otras, eficientes en cuanto a la producción de embriones, no lo son en cuanto a la calidad general de dichos embriones (Kim et al., 2008). La experiencia de nuestro grupo al respecto es que es posible inducir la proliferación de microsporas de pimiento hacia embriones utilizando un método semejante al de berenjena (Figura 5), aunque es necesario seguir trabajando para poner a punto esta metodología para poder ser utilizada de forma rutinaria.
Corral-Martínez P., Nuez F. y Seguí-Simarro J.M. (2011). Genetic, quantitative and microscopic evidence for fusion of haploid nuclei and growth of somatic calli in cultured ms1035 tomato anthers. Euphytica DOI: 10.1007/s10681-010-0303-z. Corral-Martínez P. y Seguí-Simarro J.M. (2012). Efficient production of callus-derived doubled haploids through isolated microspore culture in eggplant (Solanum melongena L.). Euphytica 187, 47-61. Corral-Martínez P. y Seguí-Simarro J.M. (2014). Refining the method for eggplant microspore culture: effect of abscisic acid, epibrassinolide, polyethylene glycol, naphthaleneacetic acid, 6-benzylaminopurine and arabinogalactan proteins. Euphytica 195, 369-382. Chupeau Y., Caboche M. y Henry Y. (1998). Androgenesis and haploid plants. (Berlin, Heidelberg.: Springer-Verlag). Kelliher T., Starr D., Wang W., McCuiston J., Zhong H., Nuccio M.L. y Martin B. (2016). Maternal Haploids Are Preferentially Induced by CENH3-tailswap Transgenic Complementation in Maize. Front Plant Sci 7. Kim M., Jang I.-C., Kim J.-A., Park E.-J., Yoon M. y Lee Y. (2008). Embryogenesis and plant regeneration of hot pepper (Capsicum annuum L.) through isolated microspore culture. Plant Cell Rep. 27, 425-434. Maluszynski M., Kasha K.J., Forster B.P. y Szarejko I. (2003). Doubled haploid production in crop plants. A manual. (Dordrecht, The Netherlands: Kluwer Academic Publishers). Palmer C.E. y Keller W.A. (2005). Overview of haploidy. En Haploids in crop improvement II, C.E. Palmer, W.A. Keller y K.J. Kasha, eds (Berlin Heidelberg: Springer-Verlag), pp. 3-9. Parra-Vega V., González-García B. y Seguí-Simarro J.M. (2013a). Morphological markers to correlate bud and anther development with microsporogenesis and microgametogenesis in pepper (Capsicum annuum L.). Acta Physiol. Plant. 35, 627-633. Parra-Vega V., Renau-Morata B., Sifres A. y Seguí-Simarro J.M. (2013b). Stress treatments and in vitro culture conditions influence microspore embryogenesis and growth of callus from anther walls of sweet pepper (Capsicum annuum L.). Plant Cell Tissue Organ Cult. 112, 353-360. Ravi M. y Chan S.W.L. (2010). Haploid plants produced by centromere-mediated genome elimination. Nature 464, 615-618. Rihova L. y Tupy J. (1999). Manipulation of division symmetry and developmental fate in cultures of potato microspores. Plant Cell Tissue Organ Cult. 59, 135-145. Rivas-Sendra A., Campos-Vega M., Calabuig-Serna A. y Seguí-Simarro J.M. (2017). Development and characterization of an eggplant (Solanum melongena) doubled haploid population and a doubled haploid line with high androgenic response. Euphytica 213, 89. Rivas-Sendra A., Corral-Martínez P., Camacho-Fernández C. y Seguí-Simarro J.M. (2015). Improved regeneration of eggplant doubled haploids from microspore-derived calli through organogenesis. Plant Cell Tissue Organ Cult. 122, 759-765. Rotino G.L. (1996). Haploidy in eggplant. En In vitro haploid production in higher plants, S.M. Jain, S.K. Sopory y R.E. Veilleux, eds (Dordrecht, The Netherlands: Kluwer Academic Publishers), pp. 115-141. Sanei M., Pickering R., Kumke K., Nasuda S. y Houben A. (2011). Loss of centromeric histone H3 (CENH3) from centromeres precedes uniparental chromosome elimination in interspecific barley hybrids. Proceedings of the National Academy of Sciences 108, E498-E505. Seguí-Simarro J.M., Bárány I., Suárez R., Fadón B., Testillano P.S. y Risueño M.C. (2006). Nuclear bodies domain changes with microspore reprogramming to embryogenesis. Eur. J. Histochem. 50, 35-44. Seguí-Simarro J.M. y Nuez F. (2005). Meiotic metaphase I to telophase II is the most responsive stage of microspore development for induction of androgenesis in tomato (Solanum lycopersicum). Acta Physiol. Plant. 27, 675-685. Seguí-Simarro J.M. y Nuez F. (2006). Androgenesis induction from tomato anther cultures: callus characterization. Acta Hort. 725, 855-861. Seguí-Simarro J.M. y Nuez F. (2007). Embryogenesis induction, callogenesis, and plant regeneration by in vitro culture of tomato isolated microspores and whole anthers. J. Exp. Bot. 58, 1119-1132. Seguí-Simarro J.M. y Nuez F. (2008a). How microspores transform into haploid embryos: changes associated with embryogenesis induction and microspore-derived embryogenesis. Physiol. Plant. 134, 1-12. Seguí-Simarro J.M. y Nuez F. (2008b). Pathways to doubled haploidy: chromosome doubling during androgenesis. Cytogenet. Genome Res. 120, 358-369. Shtereva L.A., Zagorska N.A., Dimitrov B.D., Kruleva M.M. y Oanh H.K. (1998). Induced androgenesis in tomato (Lycopersicon esculentum Mill). II. Factors affecting induction of androgenesis. Plant Cell Rep. 18, 312-317. Srivastava P. y Chaturvedi R. (2008). In vitro androgenesis in tree species: An update and prospect for further research. Biotechnol. Adv. 26, 482-491. Supena E.D.J., Muswita W., Suharsono S. y Custers J.B.M. (2006a). Evaluation of crucial factors for implementing shed-microspore culture of Indonesian hot pepper (Capsicum annuum L.) cultivars. Sci. Hort. 107, 226-232. Supena E.D.J., Suharsono S., Jacobsen E. y Custers J.B.M. (2006b). Successful development of a shed-microspore culture protocol for doubled haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Rep. 25, 1-10. Touraev A., Pfosser M. y Heberle-Bors E. (2001). The microspore: A haploid multipurpose cell. Adv. Bot. Res. 35, 53-109. Zagorska N.A., Shtereva A., Dimitrov B.D. y Kruleva M.M. (1998). Induced androgenesis in tomato (Lycopersicon esculentum Mill.) - I. Influence of genotype on androgenetic ability. Plant Cell Rep. 17, 968-973. |
|
© 2019 Grupo de Biología Celular. |
Aviso Legal |