|
Instituto de Conservación y Mejora de la Agrodiversidad Valenciana (COMAV) Grupo de Biología Celular |

|


|
Aplicaciones de la biología celular en biotecnología vegetal.
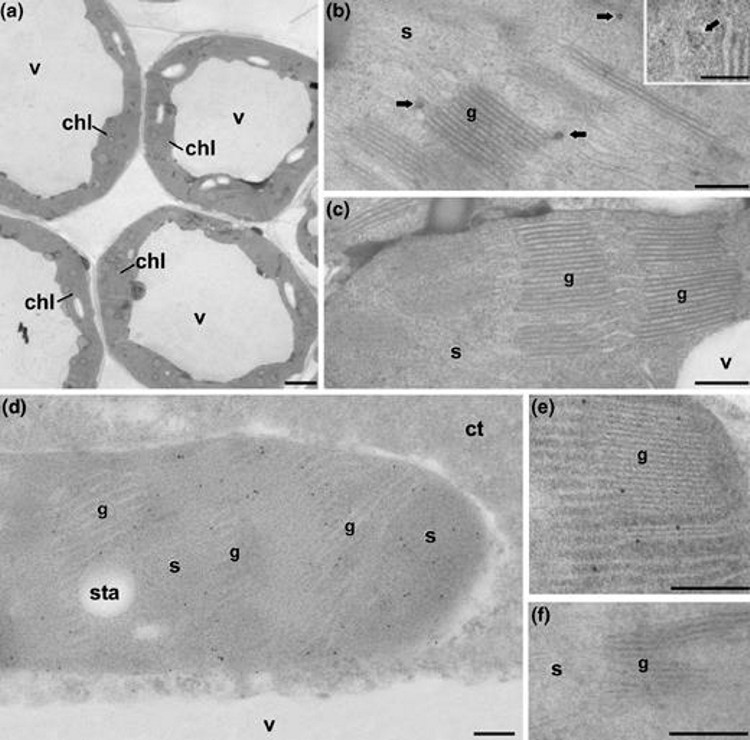
Otra de las líneas de investigación de nuestro grupo consiste en la aplicación de las diversas técnicas de biología celular disponibles en el laboratorio, al avance en el conocimiento o a la resolución de problemas concretos relacionados con el ámbito de la biología y la biotecnología vegetal. En concreto, nuestro grupo tiene años de experiencia en la aplicación al estudio de las plantas de técnicas como el cultivo in vitro, la citometría de flujo, la microscopía óptica de luz visible y de fluorescencia, la microscopía electrónica de transmisión y la de barrido. Asimismo, somos expertos en técnicas de análisis basadas en la microscopía, como la inmunolocalización (inmunohistoquímica e inmunocitoquímica) o la hibridación in situ fluorescente (FISH) y ultraestructural (para microscopía electrónica). También manejamos técnicas de análisis de imagen, cuantificación, reconstrucción y modelado tridimensional basadas en la microscopía. Además de nuestras líneas, en nuestro laboratorio hemos establecido colaboraciones científicas con diversos grupos de investigación de dentro y fuera de España, centradas en el uso de estas técnicas en torno a diversos aspectos de interés. A continuación se detallan algunas de ellas. Siguiendo esta misma filosofía, estamos abiertos a cualquier propuesta de colaboración con otros grupos, que se plantee beneficiosa en términos científicos para todos los participantes. Identificación de biomoléculas de interés terapéutico en plantas transgénicas Entre 2007 y 2011 colaboramos con diversos grupos en la identificación en células y tejidos vegetales, mediante técnicas de localización molecular in situ, de distintas proteínas de interés terapéutico. Estas moléculas son obtenidas de plantas transformadas genéticamente para su producción. Nuestro trabajo consistió en su detección in situ, en aquellos tejidos, células u orgánulos encargados de producirlos. Por ejemplo, en 2008 se publicó uno de estos trabajos en colaboración con el Instituto de Agrobiotecnología de la Universidad Pública de Navarra (Fernandez-San Millan et al., 2008) en una revista líder en el campo de la biotecnología vegetal (Plant Biotechnology Journal), en el que se demostraba la capacidad inmunogénica de las proteínas L1 producidas en plantas de tabaco. La proteína L1 es un componente de la cápsida del virus del papiloma humano, responsable del cáncer de cuello de útero. En este trabajo, se obtuvieron plantas transgénicas de tabaco que expresaban en sus cloroplastos grandes cantidades esta proteína, y nuestra colaboración consistió en la identificación de esta proteína mediante anticuerpos específicos, en los cloroplastos de las plantas transgénicas (Figura 1).
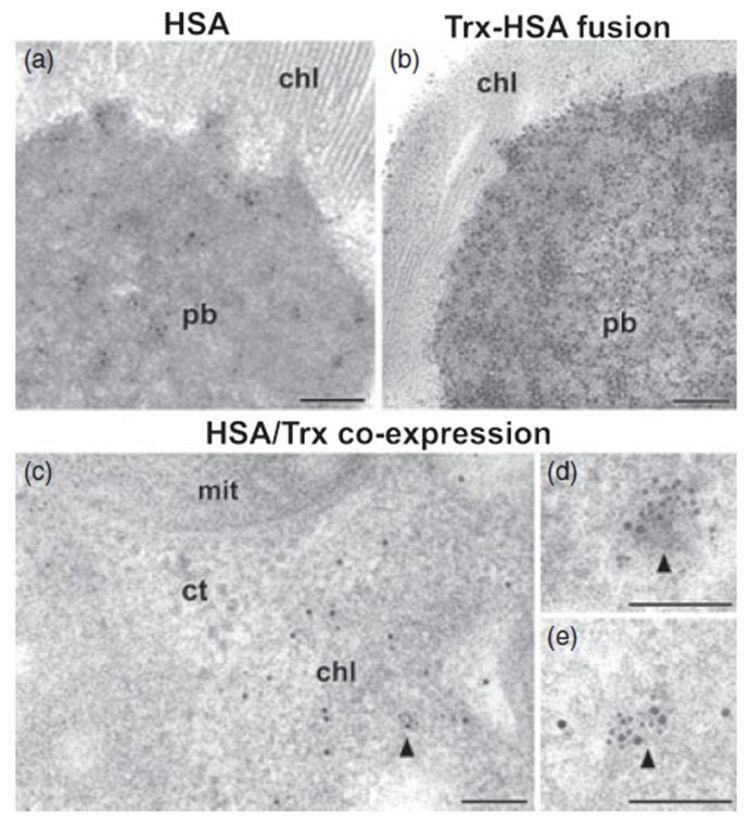
Una aproximación metodológica similar permitió identificar otra serie de proteínas recombinantes de interés terapéutico, como la seroalbúmina humana o tiorredoxinas endógenas en cloroplastos de tabaco transgénico (Figura 2). Los resultados fueron publicados en Plant Biotechnology Journal (Sanz-Barrio et al., 2013).
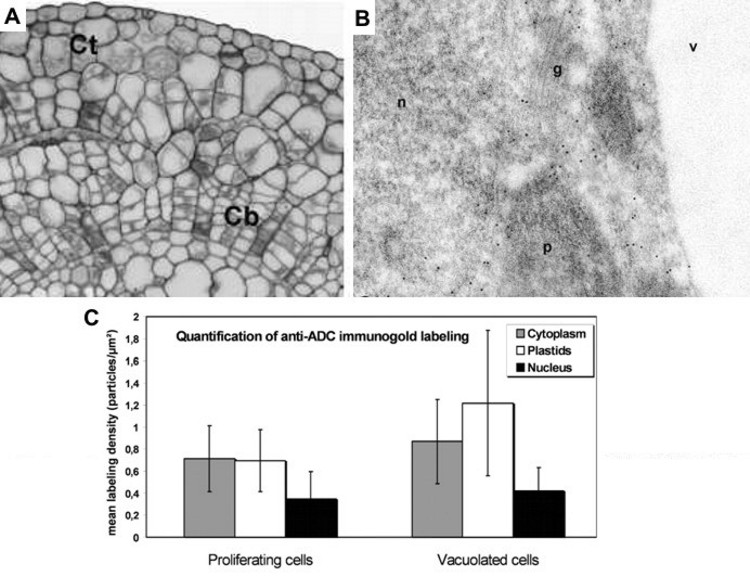
Localización in situ de la arginina descarboxilasa (ADC) durante la formación de nódulos organogénicos en lúpulo (Humulus lupulus L.) En esta colaboración con investigadores del laboratorio de Plant Systems Biology, del Center for Biodiversity, Functional & Integrative Genomics (BioFIG), del ICAT de la Universidad de Lisboa, en Portugal, hemos identificado y cuantificado la presencia y abundancia del enzima ADC en nódulos organogénicos de lúpulo en diferentes etapas de su desarrollo, una vez inducidos in vitro (Figura 3). Los resultados han sido publicados en Plant Signaling & Behavior (Fortes et al., 2011).
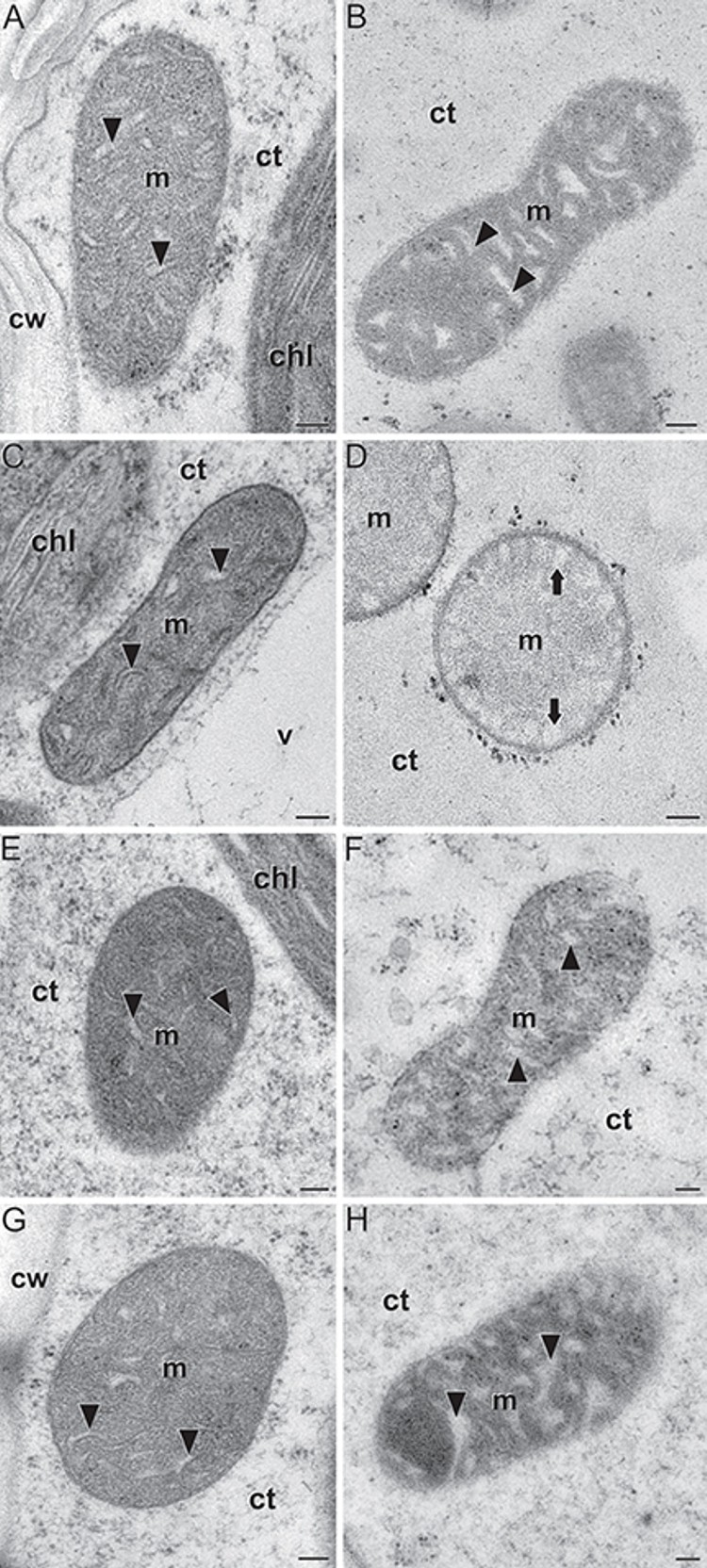
Caracterización ultraestructural de las mitocondrias del endospermo de plantas de maíz (Zea mays) normales y de mutantes zmbt1-1 En esta colaboración con investigadores del grupo del Prof. Javier Pozueta de la Universidad Pública de Navarra, caracterizamos la ultraestructura de las mitocondrias de los endospermos de individuos salvajes (wild type) y de distintos mutantes zmbt1-1 de maíz (Figura 4). El enzima Brittle1-1 de maíz (ZmBT1-1) es un componente esencial de la maquinaria de biosíntesis del almidón en endospermos de maíz. Aunque tradicionalmente se ha pensado que su localización era plastidial, en este trabajo se demuestra que también se localiza en las mitocondrias, y que su ausencia o alteración en los mutantes provoca, entre otras cosas, importantes alteraciones morfológicas y ultraestructurales, principalmente al nivel de las crestas mitocondriales. Los resultados han sido publicados en Frontiers in Plant Science (Bahaji et al., 2019).
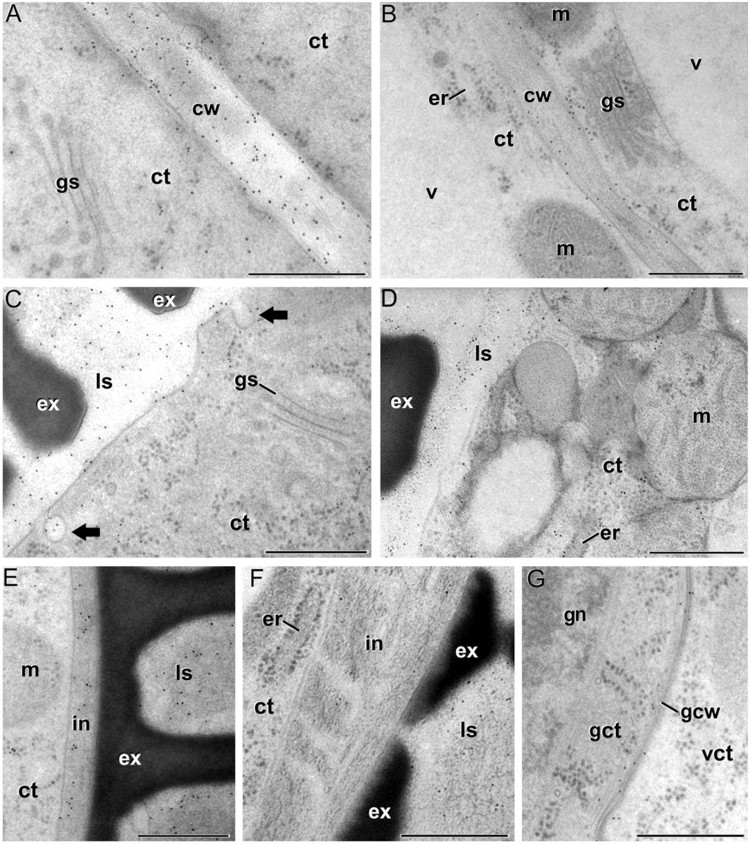
Cambios en la cantidad y distribución de distintos componentes de la pared celular de las microsporas, polen y tejidos de la antera durante el desarrollo de la antera en Brassica napus En este trabajo, realizado en colaboración con el grupo del Prof. Azeddine Driouich, de la Universidad de Rouen (Francia, eealizamos un análisis extenso y detallado de los cambios en la composición de la pared celular durante el desarrollo de la antera de Brassica napus (Figuras 5 y 6). Utilizamos inmunomarcado con oro coloidal para estudiar los patrones espaciales y temporales de la composición y distribución de diferentes epítopos de proteínas de arabinogalactano (AGPs), pectina, xiloglucano y xilano en anteras procesadas mediante criofijación por alta presión y criosustitución, cuantificando y comparando sus niveles relativos en diferentes tejidos de anteras y microsporas/polen en diferentes etapas de desarrollo. Los resultados han sido publicados en Plant and Cell Physiology (Corral-Martínez et al., 2016).
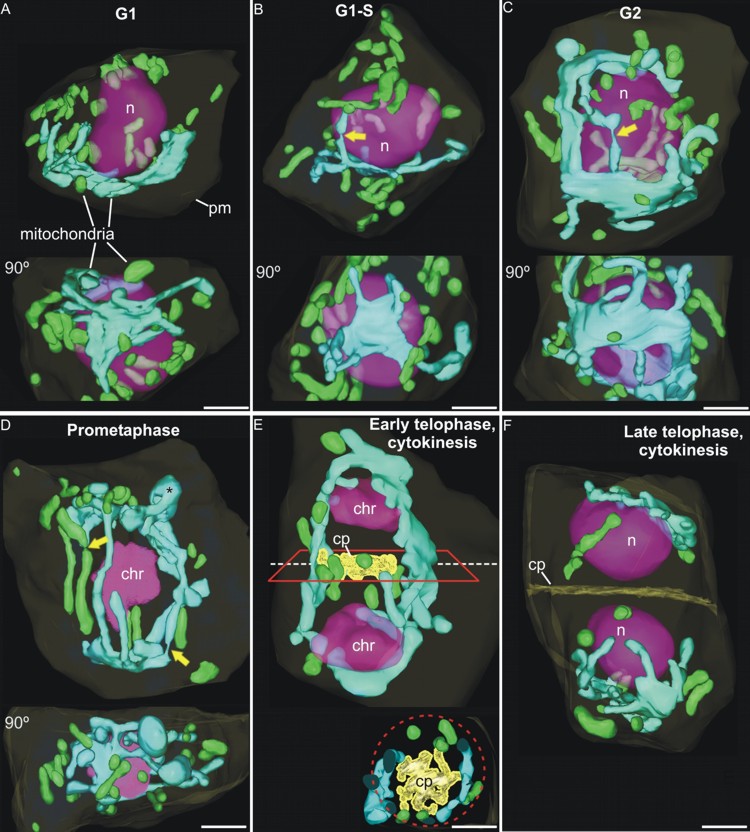
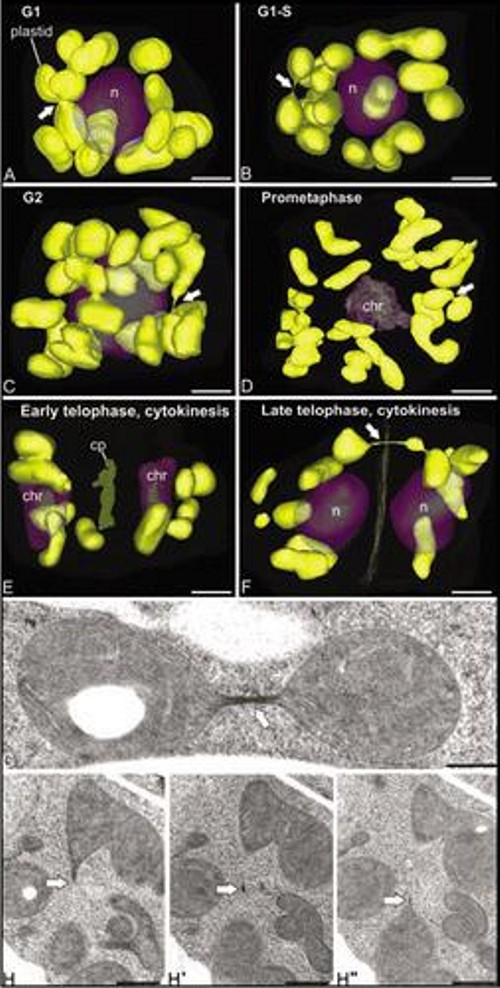
Estudio tridimensional de los cambios en morfología y distribución de la red mitocondrial de las células del meristemo apical de Arabidopsis thaliana En este trabajo, en colaboración con el Prof. Andrew Staehelin, de la Universidad de Colorado (Boulder, Colorado, EEUU), estudiamos la presencia de un tipo especial de mitocondrias reticuladas, que forman una red tridimensional dinámica alrededor del núcleo de ciertos tipos celulares meristemáticos, caracterizados por su elevada tasa de proliferación y su estado indiferenciado. Para ello utilizamos técnicas de reconstrucción tridimensional a partir de cortes seriados ultrafinos observados mediante microscopía electrónica de transmisión (Figura 7), y a partir de secciones confocales obtenidas mediante microscopía laser confocal (Figura 8). La presencia de estas mitocondrias, nunca antes descritas en plantas superiores, y del ciclo mitocondrial a ellas asociado, tiene importantes implicaciones tanto a nivel energético celular como a nivel reproductivo, en cuanto a que conforman un espacio común dentro del cual el ADN mitocondrial puede homogeneizarse y recombinar, de modo que se transmita una copia a la descendencia tan homogénea como la original. Sin embargo, otros orgánulos con ADN como los cloroplastos, no presentaron ninguna morfología no distribución más allá de la convencional y ampliamente descrita (Figura 9). Estos trabajos fueron publicados en Plant Physiology (Seguí-Simarro et al., 2008) y Plant Signaling and Behavior (Seguí-Simarro y Staehelin, 2009).
Referencias Bahaji A., Muñoz F.J., Seguí-Simarro J.M., Camacho-Fernández C., Rivas-Sendra A., Parra-Vega V., Ovecka M., Li J., Sánchez-López Á.M., Almagro G., Baroja-Fernández E. y Pozueta-Romero J. (2019). Mitochondrial Zea mays Brittle1-1 Is a Major Determinant of the Metabolic Fate of Incoming Sucrose and Mitochondrial Function in Developing Maize Endosperms. Front Plant Sci 10. Corral-Martínez P., García-Fortea E., Bernard S., Driouich A. y Seguí-Simarro J.M. (2016). Ultrastructural immunolocalization of arabinogalactan protein, pectin and hemicellulose epitopes through anther development in Brassica napus. Plant Cell Physiol. 57, 2161-2174. Fernandez-San Millan A., Ortigosa S.M., Hervas-Stubbs S., Corral-Martinez P., Seguí-Simarro J.M., Gaetan J., Coursaget P. y Veramendi J. (2008). Human papillomavirus L1 protein expressed in tobacco chloroplasts self-assembles into virus-like particles that are highly immunogenic. Plant Biotechnol. J. 6, 427-441. Fortes A.M., Costa J., Santos F., Seguí-Simarro J.M., Cordeiro A., Palme K., Altabella T., Tiburcio A.F. y Pais M.S. (2011). Arginine Decarboxylase expression, polyamines biosynthesis and reactive oxygen species during organogenic nodule formation in hop. Plant Signaling and Behavior In press. Sanz-Barrio R., Corral-Martinez P., Ancin M., Segui-Simarro J.M. y Farran I. (2013). Overexpression of plastidial thioredoxin f leads to enhanced starch accumulation in tobacco leaves. Plant Biotechnol. J. 11, 618-627. Seguí-Simarro J.M., Coronado M.J. y Staehelin L.A. (2008). The mitochondrial cycle of Arabidopsis shoot apical meristem and leaf primordium meristematic cells is defined by a perinuclear tentaculate/cage-like mitochondrion. Plant Physiol. 148, 1380-1393. Seguí-Simarro J.M. y Staehelin L.A. (2009). Mitochondrial reticulation in shoot apical meristem cells of Arabidopsis provides a mechanism for homogenization of mtDNA prior to gamete formation. Plant Signaling and Behavior 4, 168-171. |
|
© 2019 Grupo de Biología Celular. |
Aviso Legal |